KNOWLEDGE
首頁
教師資源
KNOWLEDGE
首頁
教師資源
化學科課程-弱酸的滴定
![]() MAY 31 ,2019
MAY 31 ,2019
<翻譯自PASCO智慧圖書館,轉載請註明出處>
簡介
弱酸和強酸展現了不同的化學特性,若要比較相同濃度下的pH,弱酸的pH會高於強酸,這是因為弱酸溶液不會完全的離子化,不過,當弱酸溶液遇到強鹼溶液中和時,弱酸變為傾向離子化的狀態。究竟弱酸的滴定曲線會呈現什麼狀態呢?
實驗前動動腦
- 比較強酸與弱酸的解離過程
- 醋酸為弱的單質子酸,下圖的結構為醋酸,圈出可離子化的H+
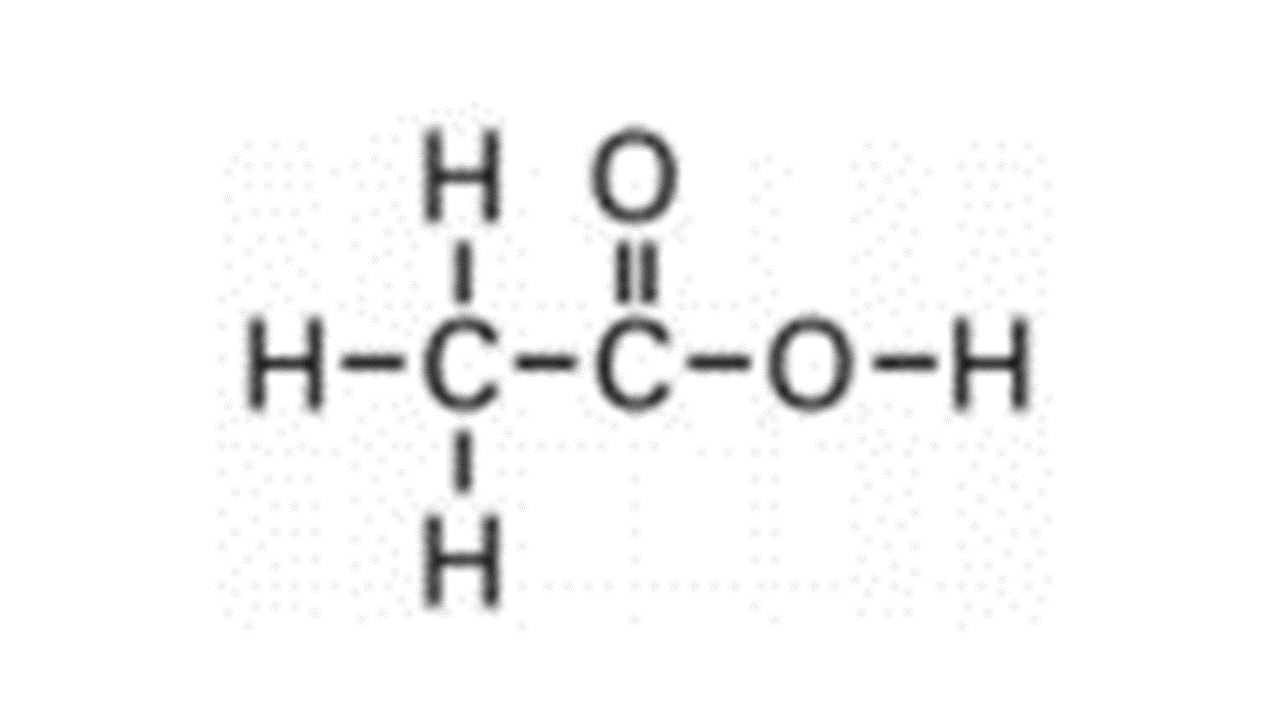
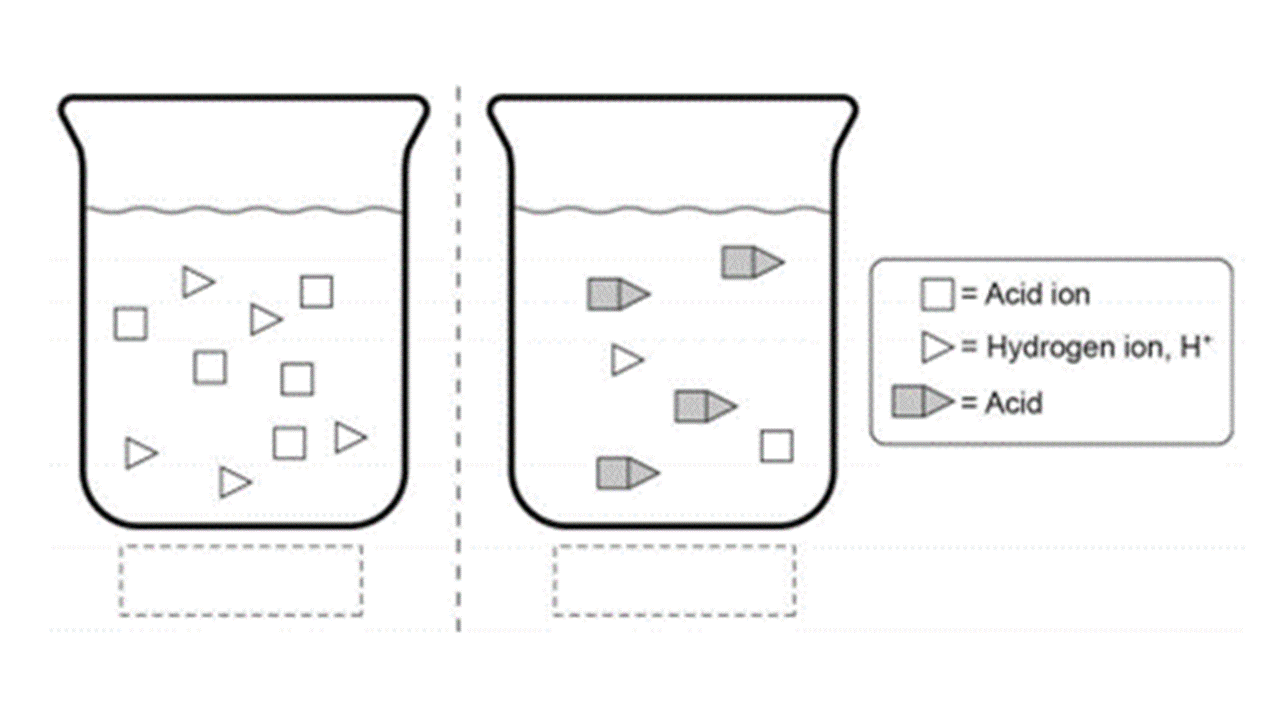
3.下圖為兩種酸性溶液的粒子模型圖,標記出何者為強酸?何者為弱酸?解釋原因
4.寫出下列方程的解離常數(Ka)表達式: HA + H2O ⇌ H3O + + A–
5.比較強酸與弱酸的解離常數(Ka),弱酸的Ka值是否大於強酸,為什麼?
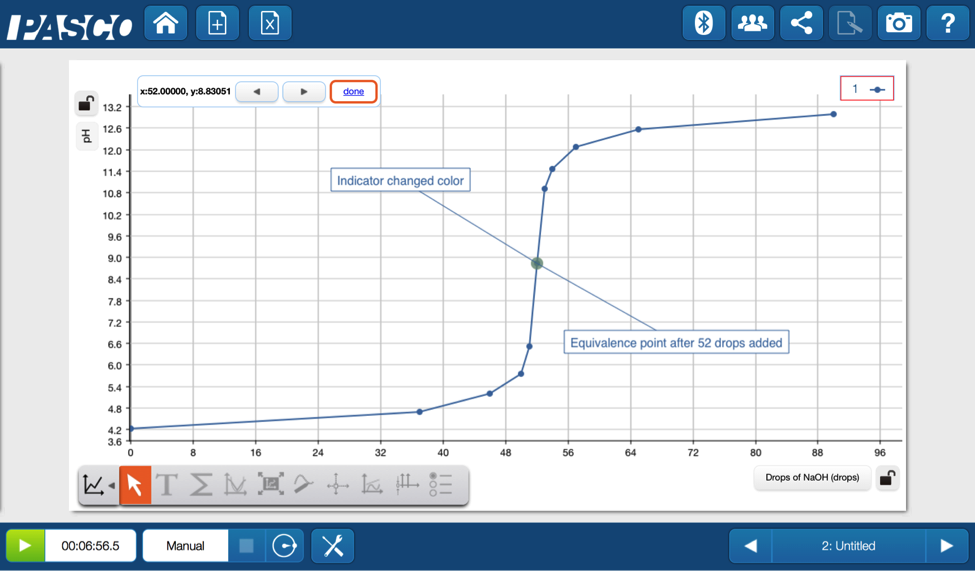
實驗搭配設備

 Facebook
Facebook

 LINE
LINE